SARS复盘,SARS疫情引发了药品产业全环节变革药监改革加速“药品加快上市注册
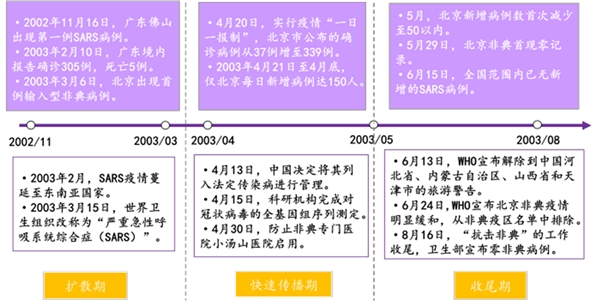
1、回顾03年发生的非典疫情,大致可分为“三阶段”:
1)第一阶段(2002/11-2003/03):扩散期。2002年11月16日,首个SARS病例出现在广东,2003年3月6日,北京出现首例输入型非典病例。这一阶段新发病例较少,疫情并未得到有效控制,非典防控仅限于医院,并且由于信息瞒报导致疫情扩散,疫情主要集中在广州、北京和中国香港。截止2003年3月底,中国内地累计报告临床诊断病例1190例,其中广东1153例,占97%。
2)第二阶段(2003/04-2003/05):快速传播期。疫情开始向其他省份扩散,逐步向北京、山西、内蒙古、河北和天津市集中,新发病例数量增多,增速加快,医护人员感染数也不断增加。中央全力应对,采取多项紧急措施,如取消大规模人群集聚活动、建立小汤山医院、对疫区给予财政拨款等。截止2003年4月底,全国累计报告非典确诊病例3460例,较3月底增加190.8%。
3)第三阶段(2003/05-2003/08):收尾期。这一阶段全国疫情稳中有降,5月29日,北京首现非典零记录。6月15日,全国范围内已无新增的非典病例。8月16日,卫生部宣布“抗击非典”工作收尾。
图表:非典疫情三阶段进展
图表:非典疫情确诊人数变化图
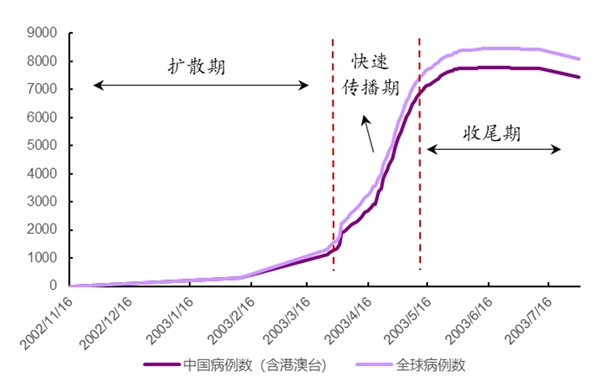
回顾SARS传播历程,不难发现彼时我国各项卫生制度存在着诸多缺陷。此后,SARS引发了药品、医疗和支付等几乎医药产业全环节的变革。
2、药监改革加速“药品加快上市注册”程序应运而生
SARS之前,新药监管体系有待完善。在SARS之前,我国的药审就处在大变革之中。1998年,为顺应医药分离的改革需求,国家药品监督管理局(SDA)成立,我国药品监管开始走向规范。2003年之前,SDA刚刚建立了(药品生产质量管理规范)GMP、(药品经营质量管理规范)GSP制度、生物制品批签发制度、地标转国标等工作,即刚刚完成了药品生产、流通监管体系的搭建,以及药品审批标准的全国统一。但在药品研发的过程监管和特殊审批等方面则几乎是空白。
SARS之下,药监局借势升格。SARS来临,SDA作为抗击疫情的前沿部门,于2003年3月增加了食品、保健品、化妆品的管理职能,升格为国家食品药品监督管理局(SFDA)。
SARS之下,“药品加快上市注册”程序应运而生。面对疫情,2003年4月21日,SFDA印发《关于加强预防诊断治疗非典型肺炎药品和医疗器械监督管理的紧急通知》,建立预防、诊断、治疗“非典”药物快速审批通道,标志着我国药审“药品加快上市注册”程序的正式建立。疫情期间,重组人干扰素α-2b喷雾剂、连花清瘟胶囊、注射用乌司他丁等多个品种基于快速审批通道审批进入临床研究。2005年11月,SFDA印发《国家食品药品监督管理局药品特别审批程序》,针对突发公共卫生事件的特别审批程序实现了制度化。此后,“药品加快上市注册”程序逐步完善,特殊审批程序、优先审评审批程序分别于2007年、2016年建立。值得注意的是,2019年12月10日的《药品注册管理办法(征求意见稿)》中提出了“突破性治疗药物”和“附条件批准程序”两种程序。
图表:“药品加快上市注册”程序
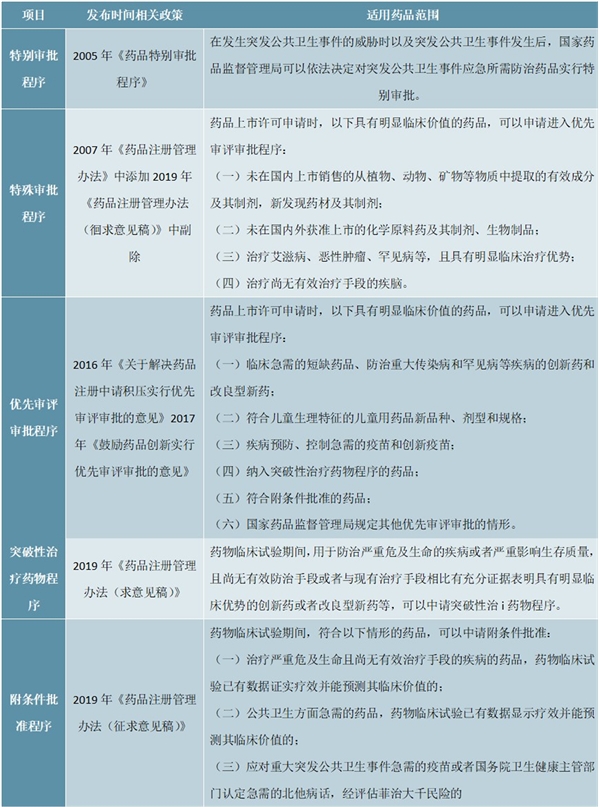
资料来源:公开资料整理
后SARS时代,GLP、GCP制度建立。SARS疫情之后,SFDA继续强势推进药审领域的改革。2003年8月,SFDA印发了《药物非临床研究质量管理规范》、《药物临床试验质量管理规范》,建立了(药物非临床研究质量管理规范)GLP、(药物临床试验质量管理规范)GCP制度。从1998年到2003年,短短5年时间,SFDA就在我国建立了GMP、GSP、GLP、GCP、国家局统一药审等现代化的医药监管制度。但在后期执行中,暴露出了腐败在内的一系列问题,导致了2007年SFDA的降格,划归卫生部管理。此后,我国药审领域的改革进度明显放缓,直到2013年,SFDA升格为CFDA(部级),药审改革又重回快车道。
我国过去20年药监领域的改革进度和药监系统的机构设置紧密相关,总的来说,在药监局级别较高的时候,药改进度较快。SARS疫情强化了药监局的地位,加速了此后药监领域的改革。
3、疫苗:市场化时代拉开序幕,国家扩大免疫规划实施
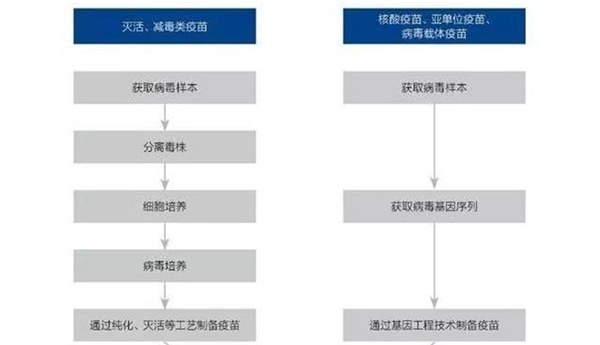
技术端:SARS之后,经过17年的努力,新技术的运用极大缩短了疫苗研发周期。传统疫苗技术(灭活、减毒活)需要将毒株进行提取、分离、培养,在经过灭活/减毒和纯化工艺进行制备,其中细胞培养的过程较漫长。二十一世纪后,基因工程技术在疫苗研发领域得到应用,新一代疫苗(如核酸疫苗、亚单位疫苗、病毒载体疫苗)颠覆了传统疫苗的生产工艺,无需经过多次传代,能够极大缩短疫苗研发周期。
图表:传统疫苗与新技术疫苗生产流程对比
产业端:疫苗企业数量急剧增加,更多民营资本投入疫苗研发。1970-2000年间是中国计划免疫时代,中生集团垄断着全国疫苗的供应体系,主要以卡介苗、脊髓灰质炎疫苗、百白破疫苗、麻疹疫苗为主。2003年SARS之后,资本对疫苗市场放开,民企纷纷涌入。2002年起将乙肝疫苗纳入儿童免疫计划,并扩大接种范围,计划免疫疫苗可预防疾病增加到15种。与此同时,国家对疫苗产业准入的行政管制开始放松,七大生物制品研究所培养的人才开始走向市场,民营企业纷纷涉足疫苗领域,外企默沙东、葛兰素史克、赛诺菲·巴斯德等也进入中国,疫苗市场经济时代开启了序幕。2000-2010年间,中国疫苗企业的数量从不到10家猛增到46家,康泰生物、智飞生物、沃森生物等上市疫苗龙头均是在这一时期成立。2012-2013年,2000s进入的民企获得产品批文,行业批签发数量激增,直至2016年“长生”事件之后批签发收紧。
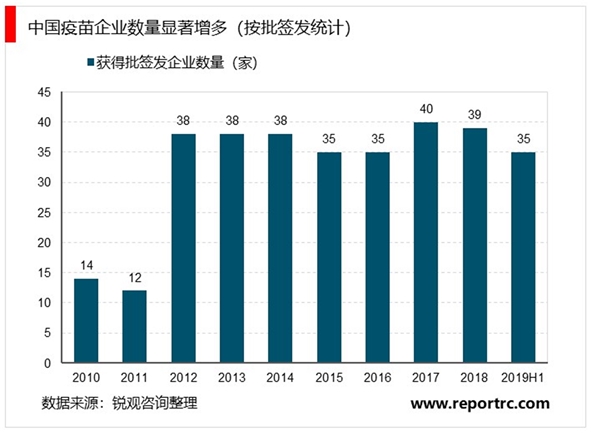
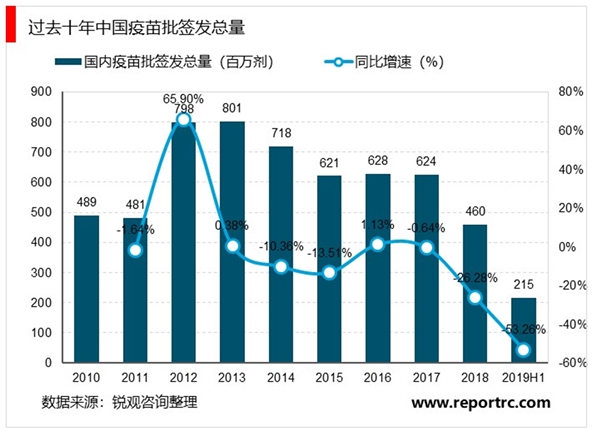
消费端:疫苗审批提速+消费市场兴起,二类疫苗市场扩大。2015年之后,国内疫苗审批提速,HPV疫苗、13价肺炎疫苗、四价流感疫苗等新消费疫苗品种快速引入中国市场,国内疫苗企业加速效仿,叠加消费升级,二类疫苗供给与需求端同时扩容,市场迅速壮大。
综合来看,SARS之后近二十年,中国疫苗产业从朦胧状态开始,不断发展壮大,涌现出若干民营疫苗龙头,不断融入全球疫苗研发与产业化体系。