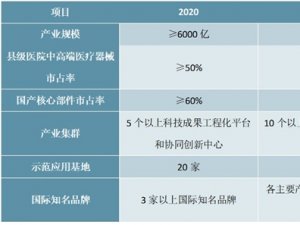
关于第一批实施医疗器械唯一标识的产品目录梳理
制订编码规则为高值耗材集采的重要条件。由于我国的高值耗材监管体系复杂,“同名异物、同物异名”的现象广泛存在,导致我国至今仍未有全国统一的医用耗材通用名称和准确的系统归类与编码标准体系,这种割裂的情况导致监管部门很难摸清高值耗材全国的临床用量需求,开展耗材“零加成”或带量采购。通过建立医疗器械唯一标识系统,有利于实现监管数据的整合和共享,提升监管效能,加强医疗器械全生命周期管理,净化市场、优化营商环境。
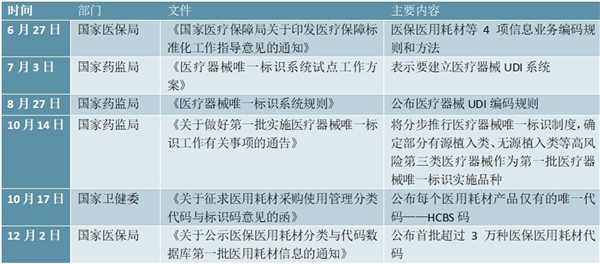
表:2019年医疗器械编码规则完善过程
资料来源:锐观咨询整理
2019年6月27日,国家医保局发布了《国家医疗保障局关于印发医疗保障标准化工作指导意见的通知》,公布了医保医用耗材等4项信息业务编码规则和方法,其中医保医用耗材信息业务编码规则规定,第1部分是耗材标识码,用1位大写英文字母“C”表示;第2部分是分类码,根据医用耗材学科、用途、部位、功能划分;第3部分是通用名码,即全国统一的医保医用耗材通用名码;第4部分是产品特征码,根据耗材材质、规格等特征赋予;第5部分是生产企业码,是依据医疗器械注册证或备案凭证为耗材生产企业赋予的唯一代码。
该规则引入了中国医学装备协会的医用耗材编码的科室分类概念,设计三级目录,方便医疗机构对接和使用;其次,借鉴了国家药监部门、卫生发展研究中心编码标准中的通用名概念;第三,进一步聚集编码功能,形成“材料标识码+分类码+通用名码+产品特征码+生产企业码”的编码结构。由此,可以通过“分类码+通用名码+产品特征码+生产企业码”满足采购功能,通过“分类码+通用名码+产品特征码”满足招标职能,通过“通用名码+产品特征码+生产企业码”满足支付职能。
2019年8月27日,国家药监局发布《医疗器械唯一标识系统规则》(UDI),自10月1日起正式施行。UDI是对医疗器械在其整个生命周期赋予的身份标识,是在产品供应链中的唯一“身份证”,用UDI可以实现药监局、卫健委、医保、税务、海关等相关部门的分类编码和映射关联,可以让各部门各省市现有编码保持不变的前提下,实现医疗器械唯一标识。在当前不同的器械编码类型中,UDI扮演核心角色,负责将其他类别的编码串联起来。
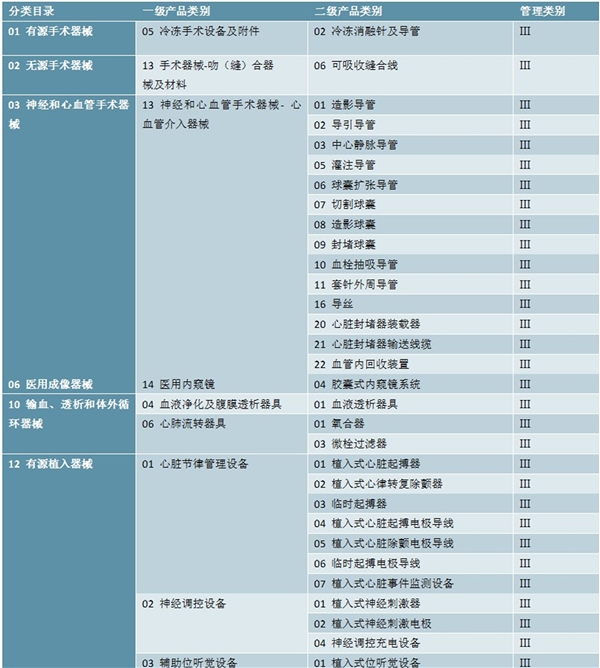
2019年10月14日,国家药监局印发了《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》,指出将分步推行医疗器械唯一标识制度,品种范围上,按照风险程度和监管需要,确定部分有源植入类、无源植入类等高风险第三类医疗器械作为第一批医疗器械唯一标识实施品种。心脏起搏器、髋关节假体、整形用注射填充物等九大类64个品种被列入第一批实施医疗器械唯一标识的产品目录。
表:第一批实施医疗器械唯一标识的产品目录-1
数据来源:国家医保局,锐观咨询整理
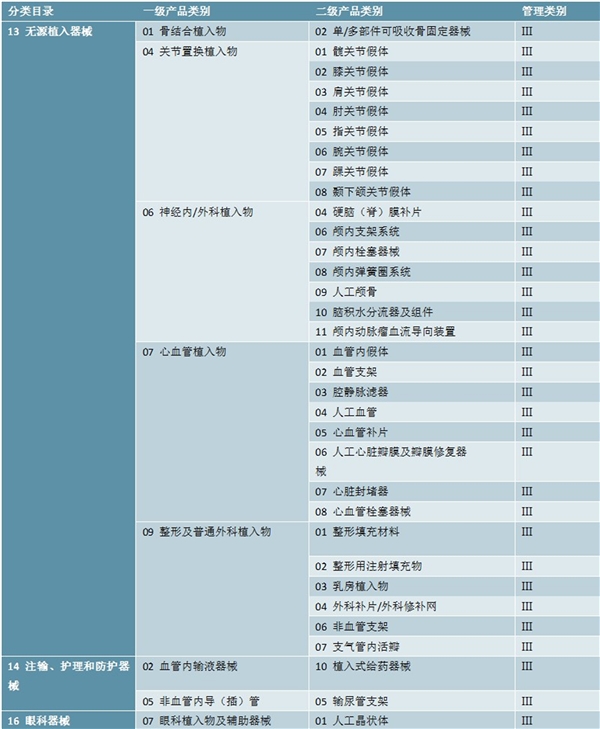
表:第一批实施医疗器械唯一标识的产品目录-2
数据来源:国家医保局,锐观咨询整理
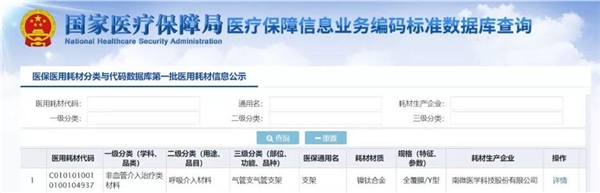
2019年12月2日,国家医保局发布《关于公示医保医用耗材分类与代码数据库第一批医用耗材信息的通知》,公布首批超过3万种医保医用耗材代码,涉及116家企业和64类品种。
图:医保医用耗材信息业务编码规则
资料来源:医保局