体外诊断行业试剂注册流程及法律法规梳理
根据《体外诊断试剂注册管理办法》,体外诊断试剂是指在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可单独使用,也可以与仪器、器具、设备或者系统组合使用。由于其特殊性,体外诊断试剂不能与其他医疗器械作为同一注册单元进行申报。
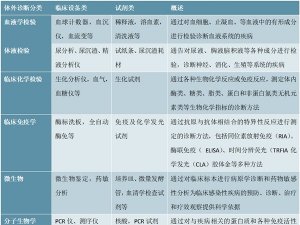
体外诊断试剂分类
根据产品风险程度由低到高,体外诊断试剂分为第一类、第二类、第三类产品。第一类体外诊断试剂实行备案管理,第二类、第三类体外诊断试剂实行注册管理。对新研制的尚未列入体外诊断试剂分类目录的体外诊断试剂,申请人可以直接申请第三类体外诊断试剂产品注册,也可以依据分类规则判断产品类别向国家食品药品监督管理总局申请类别确认后,申请产品注册或者办理产品备案。
表:体外诊断试剂分类
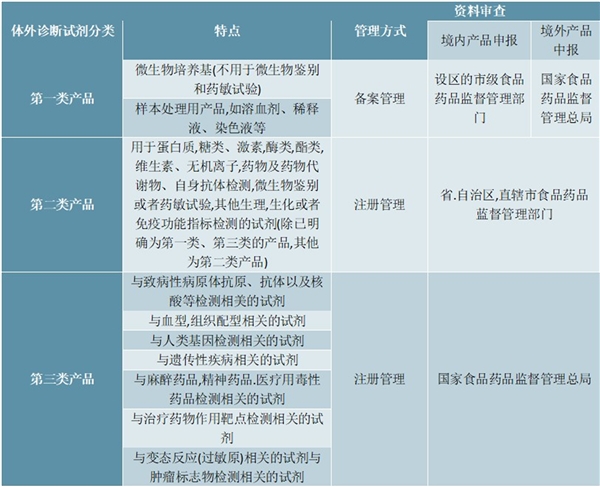
资料来源:锐观咨询整理
体外诊断试剂申报资料要求
体外诊断试剂的申报资料是产品上市准入的一项重要内容,是产品安全有效的证据之一,覆盖了产品设计开发过程中性能验证和确认的关键环节。主要包括:综述资料、主要原材料及反应体系研究资料、分析性能评估资料、阳性判断值或参考区间确定资料、稳定性研究资料、临床评价资料、产品风险分析资料、产品技术要求、产品检验报告、产品说明书。
表:体外诊断试剂申报资料
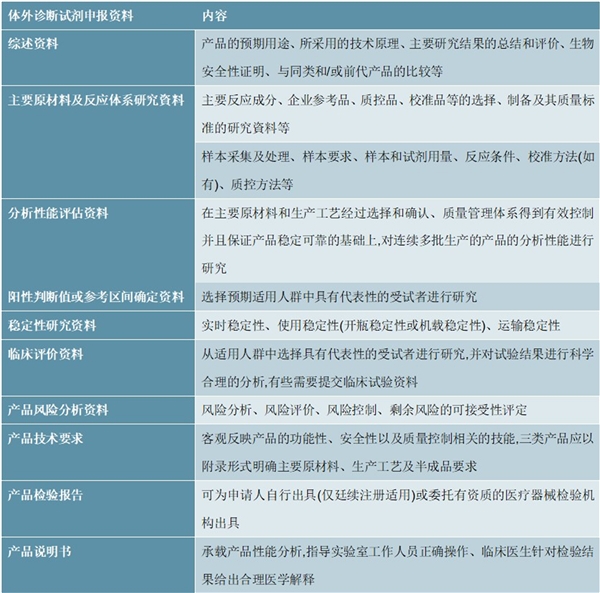
资料来源:锐观咨询整理
产品检验
与医疗器械的注册检验类似,对于首次进行注册申请的第二类、第三类体外诊断试剂,需要有相应医疗器械资质的医疗器械检验机构进行注册检验或委托检验;而第一类体外诊断试剂由于采用备案管理,备案人可以提交产品自检报告。产品检验的要求如下:
a)医疗器械检验机构应当依据产品技术要求的性能指标和检验方法对产品样品
进行检验,并出具产品技术要求预评价意见;
b)有国家标准品、参考品的产品应当使用国家标准品、参考品进行注册检验;
c)有适用的医疗器械行业标准的产品应当参考相关行业标准的性能指标和检验方法对产品进行检验,原则上不低于相关行业标准的要求。
另外需要注意的是,第三类产品应当对连续3个批次生产的样品进行注册检验;如注册申报过程中涉及产品技术要求的修订等情况,应在原检验机构进行补充检验。
临床试验
同样地,第二类、第三类体外诊断试剂注册时一般也需要进行临床试验。在满足基本原则的情况下可接受境外临床试验数据,提交境外临床试验资料时需考虑境内和境外技术审评要求的差异,受试人群差异以及临床试验条件差异等。
表:体外诊断试剂临床试验资料
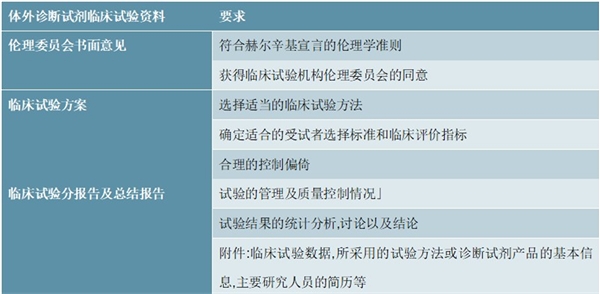
资料来源:锐观咨询整理
免于临床试验
一类体外诊断试剂、列入《免于进行临床试验的体外诊断试剂目录》的二类和三类体外诊断试剂,可以免于进行临床试验;另外,校准品、质控品也无需提供临床资料。免于进行临床试验的体外诊断试剂,应进行临床评价。国家食品药品监督管理总局组织制定并于2017年11月3日发布了《免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)》,从适用范围、基本要求、临床评价途径、试验方法、临床评价报告、其他评价资料六个方面描述了临床评价试验的基本要求及申报资料的相关要求。
(1)突出了申请人主体责任。明确了申请人自行或委托其他机构或实验室在中国境内完成临床评价工作,试验过程由申请人进行管理,评价报告应由申请人/代理人签章,试验数据的真实性由申请人负责。
(2)强调了样本来源追溯性的要求。要求评价用样本(病例)原始资料中应至少包括样本来源、唯一且可追溯的编号、年龄、性别、样本类型、样本临床背景信
息等内容。
(3)规定了临床评价的两种途径。申请人根据申报产品的具体情况建立适应的评价方法,充分考虑产品的预期用途,开展具有针对性的评价研究,可以选择与境内已上市同类产品进行比较研究试验,证明两者具有等效性;或者与参考方法进行比较研究试验,考察待评价试剂与参考方法的符合率/一致性。
(4)明确了临床评价的试验方法。可参考相关方法学比对的指导原则开展试验,并根据产品特点选择合适的统计学方法进行统计分析,以求得到客观可信的结果。
新研制体外诊断试剂
对于新研制体外诊断试剂而言,选择适当的受试者,采用试验用体外诊断试剂与诊断该疾病的“金标准”进行盲法同步比较。对用于早期诊断、疗效监测、预后判断等用途的体外诊断试剂,在进行与“金标准”的比较研究的同时,还必须对受试者进行跟踪研究。研究者应明确受试者的入选标准、随访标准和随访时间。
a)“金标准”的确定:“金标准”是指在现有条件下,公认的、可靠的、权威的诊断方法。临床上常用的“金标准”有组织病理学检查、影像学检查、病原体分离培养鉴定、长期随访所得的结论及临床常用的其他确认方法等。
b)受试者的选择:受试者应包括两组,一组是用“金标准”确定为有某病的病例组,另一组是经“金标准”确定或有临床证据证实无该病的患者或正常人群,作为对照组。病例组应包括该病种的不同病例,如症状典型和非典型的,病程早、中、晚期的,病情轻、中、重型的,不同性别、不同年龄层次的等,以便能反映该病的全部特征。对照组应包括确定无该病的患者,及易与本病相混淆疾病的病例。
c)同步盲法测试:经“金标准”确定的病例组与对照组中的受试者样本同步接受试验用体外诊断试剂的检测,将检测结果与“金标准”判定的结果进行比较,计算试验用体外诊断试剂检测结果与“金标准”判断结果符合或差异程度的统计学指标,再根据这些指标对试验用体外诊断试剂进行评价。在试验操作的全过程和判定试验结果时,采用盲法(尽可能用双盲法)是保证临床试验结果真实可靠的关键。
“已有同品种批准上市”产品的临床试验选择已上市产品,采用试验用体外诊断试剂与已上市产品针对临床样本进行比较研究试验,证明试验用体外诊断试剂与已上市产品等效。
a)对比试剂的选择:在采用已上市产品作为对比试剂的前提下,选择目前临床普遍认为质量较好的产品。同时应充分了解所选择产品的技术信息,包括方法学、临床预期用途、主要性能指标、校准品的溯源情况、推荐的阳性判断值或参考区间等,以便对试验结果进行科学的分析。
b)对于比较研究试验中测定结果不符的样本,应采用“金标准”或其他合理的方法进行复核,以便对临床试验结果进行分析。如无需复核,应详细说明理由。