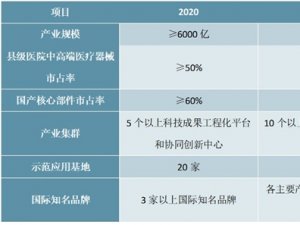
医疗器械上市许可持有人相关制度及MAH制度对我国医疗器械企业的影响梳理
1、医疗器械上市许可持有人制度
上市许可持有人(MarketingAuthorizationHolder,MAH)制度又称“注册人制度”,是一种将上市许可与生产许可相分离的管理模式。在这种模式下,上市许可持有人可以将产品的生产委托给其他专门的生产商,而产品的安全性、有效性等质量保障则均由上市许可持有人负责。由此,通过将上市许可和生产许可进行“解绑”,可以有效抑制医疗器械制造企业的低水平重复建设,提高新型产品研发和生产的积极性,推动委托生产行业快速发展,从而在整体上达到促进我国医疗器械行业繁荣发展的目的。
医疗器械MAH制度的目标主要有三点:一是构建一个自始至终为医疗器械的产品质量承担管理义务的责任主体;二是解除医疗器械产品上市许可和生产许可的捆绑关系,让医疗器械MAH成为疏通产品注册与生产管理壁垒的主体;三是优化医疗器械行业资源的分配,刺激行业研发投入增加,为高技术含量的新产品研发扫除障碍,从而推动整个行业的创新发展。
医疗器械MAH制度的关键内容包括:首先,允许科研机构和研发人员作为注册申请人,提交医疗器械临床试验申请和上市许可申请,取得医疗器械注册证的申请人即转变为医疗器械注册人,也就是医疗器械MAH。其次,医疗器械MAH具备相应生产资质的,既可自行生产,也可委托生产。持有人不具备生产条件的,可以直接委托具备资质的企业生产产品。第三,在医疗器械委托生产中,如果受托方不具备生产资质,可凭委托方的注册证办理生产许可。第四,医疗器械注册人可委托多个受托方进行生产。
在医疗器械MAH制度实施之前,上市许可一般只颁发给具有医疗器械生产资质的企业,研发机构和科研人员并没有独立获得上市许可的机会。在医疗器械委托生产的过程中,一般规定只能指定一家生产企业作为受托人。也就是说,医疗器械从产品注册到委托生产这一过程中,注册与生产是深度捆绑的,这导致行业资源流动受限和社会生产分工受阻,最终影响行业整体的健康发展。
2、MAH试点工作开展情况
2016年6月,我国开始在北京、上海、江苏等10个省、直辖市试点药品上市许可持有人制度(marketingauthorizationholder,MAH);2017年10月8日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确提出了医疗器械上市许可持有人的概念,要求在医疗器械行业同时实施MAH制度。2017年12月7日,上海市食品药品监督管理局发布了关于实施《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》的通知,上海方案首次提出允许自贸试验区内医疗器械研发机构和科研人员申请医疗器械上市许可、医疗器械注册申请人委托辖区内医疗器械生产企业生产产品、注册人多点委托生产、受托生产企业提交注册人持有的医疗器械注册证申请生产许可,并强调上市许可持有人对医疗器械设计开发、临床试验、生产制造、销售配送、不良事件报告等承担全部法律责任,推动上市许可持有人制度全面实施。2018年1月,国家药品监管部门同意上海开展医疗器械注册人制度试点,正式启动了我国医疗器械注册人制度在上海先行先试。
2018年5月,国务院印发《进一步深化中国(广东)、(天津)、(福建)自由贸易试验区改革开放方案》,提出创新贸易综合监管模式,积极推动前沿新兴技术和产业孵化,允许广东、天津自贸区内医疗器械注册申请人委托相应辖区内医疗器械生产企业生产产品。自此,全国开展医疗器械MAH制度试点的省份(直辖市)增加至3个。2019年2月22日,国务院批复同意《全面推进北京服务业扩大开放综合试点方案》,推进京津冀地区协同发展,首次提出助推“注册+生产”跨区域产业链发展的目标,允许北京市医疗器械注册人委托京津冀地区医疗器械生产企业生产医疗器械。在这之后,国家药监局在上海、江苏等地召开座谈会,邀请19个省(区、市)药监部门参加,总结上海等地MAH制度的试点经验,分析试点实施情况,对试点地区进行追踪评估,并进一步加强MAH的推广工作。
2019年8月1日,国家药监局发布《关于扩大医疗器械注册人制度试点工作的通知》(下称《通知》),在已有的上海、广东、天津三地试点基础上,将医疗器械MAH制度试点扩大到北京、天津、河北、辽宁、黑龙江、上海、江苏、浙江、安徽、福建、山东、河南、湖北、湖南、广东、广西、海南、重庆、四川、云南、陕西等21个省(市、自治区)。《通知》进一步明确了参与试点工作的地区注册人与受托生产企业的具体条件和义务责任,规定了产品注册、变更与生产企业许可等办理程序,同时还强调了各级药品监管部门应当加强对注册人履行保证医疗器械质量、上市销售与服务、不良事件检测与评价及召回等义务情况的监督管理。同月,国务院印发《关于6个新设自由贸易试验区总体方案的通知》,进一步明确了山东、江苏、广西、河北、云南、黑龙江6个自贸区开展制度试点的方向与要求。
2019年10月29日,上海、江苏、浙江、安徽药监局联合发布《长江三角洲区域医疗器械注册人制度试点工作实施方案》,这是我国首个“跨省”试点实施方案,格外引人瞩目。该方案聚焦注册人跨省委托生产,谋划破解多地监管职权划分,检查尺度统一等问题,开展品种属人、受托企业属地监管的实践,探索构建区域产业专业、分化重组、创新集聚、信息化监管新机制,促进跨区域创新链、产业链大协作,形成特色化、规模化医疗器械产业集群,推动长三角医疗器械产业一体化高质量发展。
截至2019年12月19日,21个试点省(区、市)药监局全部完成试点工作实施方案发布,其中20个省局方案提出鼓励购买产品责任保险,10个提出对试点产品实施优先审评审批,12个提出受托企业生产需要质量体系认证,对所有试点范围均不涉及国家禁止委托生产医疗器械目录中的产品。
3、MAH制度对我国医疗器械企业的影响
允许研发机构和科研人员申请上市许可。MAH制度改写了过去医疗器械产品注册和生产许可“相互捆绑”的历史,允许符合条件的医疗器械研发机构、科研人员、医生等成为注册申请人,单独申请医疗器械注册证,并委托有资质和生产能力的企业进行生产。持有人制度还将改变我国原有制度下,科研人员只能通过技术转让或隐名持股获得短期利益、隐名利益的尴尬局面,极大地鼓励研发机构和科研人员从事医疗器械创新,有效激发市场活力,加快我国由医疗器械生产大国向创新大国的转变。
研发型企业专注研发环节,降低企业成本。据统计,我国医疗器械相关企业共有4万多家,其中生产企业约1.6万家,且90%以上为中小型企业,技术含量较低,年产值过亿的企业不足400家。医疗器械MAH制度的推出可有效解决初创企业早期面临的资金有限、生产人员缺乏等困境,让创新企业、研发企业专注于产品的研发环节,把生产环节开放给服务企业,在加强创新的同时降低企业成本。例如,采用外包方式生产二类(气腹机等)医疗器械的企业三年便可节约费用近1000万元,同时还可以大幅缩短产品的上市周期,实现新产品的快速产业化,使企业更具市场竞争力。
优化资源配置,产业链整体受益。数据显示,我国中小医疗器械生产企业的工厂使用率只有5%-10%,造成大量资源浪费。施行MAH制度后,医疗器械研发机构和科研人员可以选择自行生产或委托生产,有效避免企业低水平重复现象,改善同一品种多家许可、多家竞争的局面,提高资源的使用效能。此外,MAH制度还可促进医疗器械行业的专业化分工进程。创新型企业专注源头创新,CRO辅助企业研发,CMO进行产品生产落地,医疗器械服务企业也可加速进行市场布局。可以预计,持有人制度全面实施后,我国医疗器械产业将快速进入分化与重组的时期,产品产业集中、创新集聚的步伐将进一步加快,市场竞争、生态优化的活力将进一步迸发。
落实企业责任,强化全程管理。在MAH制度下,上市许可持有人对医疗器械质量的全生命周期负责,这种明确而严格的责任制度将有效强化持有人“从实验室到医院”管理责任的全面落实。同时,医疗器械管理的直接对象将从多元主体转移到单一主体,管理的核心内容将从准入资格管理转移到体系能力管理,管理的基本方式将从传统管理转移到现代管理,我国的医疗器械行业将进入全新的智慧管理时代。
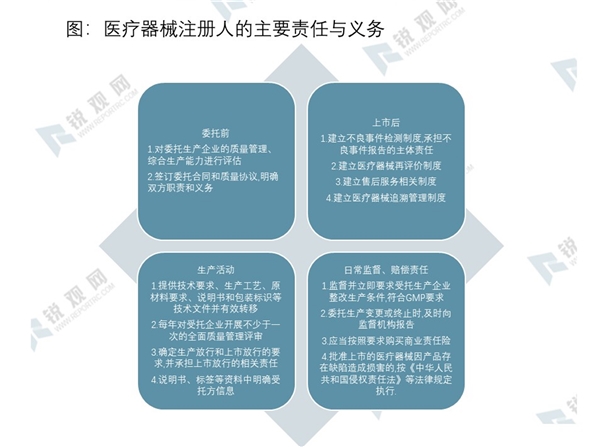
资料来源:锐观咨询整理