一文解读创新医疗器械相关审评及审批内容
随着我国医疗器械行业快速发展,企业创新活力不断提高,审评审批制度改革也在持续推进。但总体来看,我国的医疗器械依然面临着创新支撑不足的困境,产品与国际先进水平仍有不小的差距。为了进一步支持我国产业发展,激发医疗器械企业的创新潜力,满足实际临床中的不同需求,我国于2014年3月1日起施行
《创新医疗器械特别审批程序(试行)》,针对创新型医疗器械制定了优先审评审批的方案。2018年12月1日,国家药品监督管理局在广泛征询了各方意见后,修订并开始实施新的《创新医疗器械特别审查程序》,进一步完善了适用情形、细化了申请流程、提升了创新审查的实效性,并明确对创新医疗器械的许可事项变更优先办理,为我国的医疗器械产业发展提供了有力的政策支持。
适用对象和条件
创新医疗器械特别审查程序仅适用于符合《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》所规定和明确的医疗器械首次注册形式,不适用于延续注册或许可事项变更形式。同时,第一类医疗器械由于施行备案管理也不在适用范围之内。具体适用条件如下(需同时满足):
1)申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权,创新医疗器械特别审查申请时间距专利授权公告日不超过5年;或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,报告载明产品核心技术方案具备新颖性和创造性。
2)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
3)产品主要工作原理或者作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,且具有显著的临床应用价值。
创新器械特别审查程序
食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审查的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。与普通审评审批程序相比,特别审查程序并不会降低审批标准或减少审批步骤,只是在满足条件的情况下,予以优先审批,以减少审批时间。
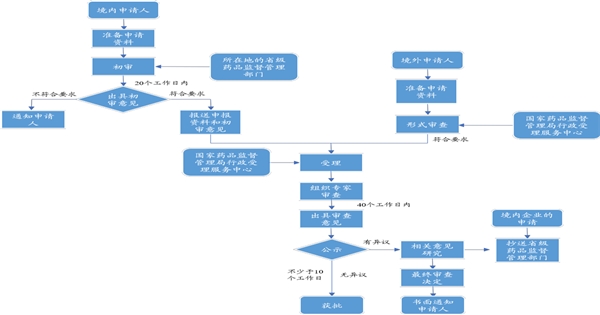
主要审批流程
1)初审:境内申请人向所在地的省级药品监督管理部门提出创新医疗器械特别审查申请,由省级主管部门对是否符合适用条件进行初审,并于20个工作日内出具初审意见。境外申请人应直接向国家药品监督管理局提出审查申请。
2)受理:省级药品监督管理部门将申报资料和初审意见一并报送国家药品监督管理局行政事项受理服务和投诉举报中心,由其对申请申报资料进行形式审查,对符合申请资料要求的予以受理。
3)专家审查:由国家药品监督管理局医疗器械技术审评中心设立创新医疗器械审查办公室,组织专家进行审查,应当于收到申请后60个工作日内出具审查意见。
4)公示:创新医疗器械审查办公室对拟进行特别审查的申请项目应当在国家药品监督管理局医疗器械技术审评中心网站将申请人、产品名称予以公示,公示时间应不少于10个工作日。如有异议,则由创新医疗器械审查办公室做出最终审查决定并进行公示。
图:创新医疗器械审评审批流程
创新审查通过后优先办理
对于经审查同意按本程序审查的创新医疗器械,申请人所在地省级药品监督管理部门应当指定专人,应申请人的要求及时沟通、提供指导。在收到申请人质量管理体系核查申请后,应当予以优先办理。对于创新医疗器械,医疗器械检验机构在进行检验时,应当优先进行检验,并出具检验报告。器审中心对已受理注册申报的创新医疗器械,应当优先进行技术审评;技术审评结束后,国家药品监督管理局优先进行行政审批。按本程序审查获准注册的医疗器械申请许可事项变更的,国家药品监督管理局予以优先办理。
变更与终止
审查结果告知后5年内,未申报注册的创新医疗器械,不再按照本程序实施审查。
5年后,申请人可按照本程序重新申请创新医疗器械特别审查。
创新医疗器械临床研究工作需重大变更的,如临床试验方案修订,使用方法、规格型号、预期用途、适用范围或人群的调整等,申请人应当评估变更对医疗器械安全性、有效性和质量可控性的影响。产品主要工作原理或者作用机理发生变化的创新医疗器械,应当按照本程序重新申请。
属于下列情形之一的,国家药品监督管理局可终止本程序并告知申请人:
(1)申请人主动要求终止的;
(2)申请人未按规定的时间及要求履行相应义务的;
(3)申请人提供伪造和虚假资料的;
(4)全部核心技术发明专利申请被驳回或视为撤回的;
(5)失去产品全部核心技术发明专利专利权或者使用权的;
(6)申请产品不再作为医疗器械管理的;
(7)经专家审查会议讨论确定不宜再按照本程序管理的。
自2014年2月7日,原国家食品药品监督管理总局发布了《创新医疗器械特别审
批程序(试行)》以来,多个项目进入特别审批流程,例如达安基因的21三体、
18三体和13三体检测试剂盒,迈瑞医疗的具有心肺复苏质量监测功能的病人监
护系统,先健科技的多项心血管产品等。在政策起始发布的2014年,按照特别程序进行审批的医疗器械注册申请仅占全部申请的10.9%,至2017年已递增至近20%。特别审批程序对医疗器械研发创新、新技术推广应用、产业高质量发展起到积极推动作用。据统计,对创新器械平均审评审批时间较其他普通三类首次注册产品压缩83天,创新产品从研发到上市的时间进一步缩短。
为深入推进审评审批制度改革,鼓励医疗器械创新,深化供给侧结构性改革和“放管服”改革要求,激励产业创新高质量发展,国家药监局多次开展调研,组织专题研究,多方征求意见,对特别审批程序进行研究修改,又于2018年发布了新修订的《创新医疗器械特别审查程序》,自2018年12月1日起施行。根据统计,截止2019年12月31日,已有236个产品进入创新医疗器械特别审查通道,73个创新产品获得注册证。2019年,上海微创的“腹主动脉覆膜支架及输送系统”、上海普实的“左心耳封堵器系统”、北京迈迪顶峰的“左心耳闭合系统”、兰州科近泰基的“碳离子治疗系统”、上海联影医疗的“正电子发射及X射线计算机断层成像扫描系统”、杭州优思达的“核酸扩增检测分析仪”等19款创新产品获得国家药品监督管理局批准注册。国家科技部已遴选出第一批《创新医疗器械产品目录(2018)》,一共包括87个创新医疗器械产品,其中9项国际原创、55项国内首创、23项重大科技提升,树立我国持续科技研发的标杆。