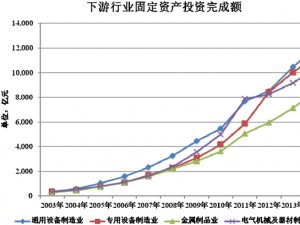
临床前CRO行业发展有利因素及不利因素
1、临床前CRO行业发展有利因素:
(1)国家产业政策鼓励、支持新药研发
2012年1月,国家工信部发布《医药工业“十二五”发展规划》,将技术创新能力增强列为“十二五”期间医药工业主要发展目标之一,为医药行业自主创新确立了量化目标:重点骨干企业研发投入达到销售收入的5%以上,创新能力明显提高;获得新药证书的原创药物达到30个以上,开发30个以上通用名药物新品种,完成200个以上医药大品种的改造升级,开发50个以上掌握核心技术的医疗器械品种。《医药工业“十二五”发展规划》还将增强新药创制能力列为医药工业发展的首要任务,指出要提升生物医药产业水平,持续推动创新药物研发,加快推进创新药物开发和产业化,支持企业在国外开展创新药物临床。
国家“重大新药创制”科技重大专项提出,要研制一批具有自主知识产权和市场竞争力的创新药,建立一批具有先进水平的技术平台,形成支撑我国药业自主发展的新药创新能力与技术体系,使我国新药创制整体水平显著提高,推动医药产业由仿制为主向自主创新为主的战略转变。“十一五”期间,国家共投入近200亿元用于该专项。截至2012年底,新药创制专项共立项1,251个课题,中央财政共投入97亿元,地方配套41亿元,带动企业投入193亿元8。原卫生部(现国家卫生与计划生育委员会)部长陈竺在第六届生物产业大会上表示,在“十二五”投入400亿元人民币进行财政扶持的基础上,“十三五”期间将再投入750亿元资金对专项进行扶持,以求带动、促进地方及制药企业加大创新药研发投入,尤其是推动生物医药产业快速发展。
2016年10月26日,工业和信息化部、国家发展和改革委员会、科学技术部、商务部、国家卫生和计划生育委员会、国家食品药品监督管理总局等六部委联合印发的《医药工业发展规划指南》对医药工业发展提出目标,到2020年,医药工业规模效益稳定增长,创新能力显著增强,主营业务收入保持中高速增长,年均增速高于10%,占工业经济的比重显著提高;企业研发投入持续增加,到2020年,全行业规模以上企业研发投入强度达到2%以上;创新质量明显提高,新药注册占药品注册比重加大,一批高质量创新成果实现产业化,新药国际注册取得突破。
国家及制药企业对创新药研发的重视、支持和资金投入,将推动我国临床前CRO行业的进一步发展。
(2)国家产业政策直接鼓励CRO行业发展
工信部发布的《医药工业“十二五”发展规划》明确指出,要“加强医药创新体系建设,完善医药创新支撑服务体系,加强药物安全评价、新药临床评价、新药研发公共资源平台建设”。《医药工业“十二五”发展规划》中明确鼓励发展合同研发服务,推动相关企业在药物设计、新药筛选、安全评价、临床试验及工艺研究等方面开展与国际标准接轨的研发外包服务,创新医药研发模式,提升专业化和国际化水平。
依据商务部和国家发展改革委发布的《中国国际服务外包产业发展规划纲要(2011-2015)》(以下简称“《纲要》”),医药研发国际服务外包被列为巩固提升的优势领域,指出“我国医药研发产业链日益成熟,医药研发外包市场规模不断扩大,跨国制药公司研发中心加快向中国转移。‘十二五’期间要积极参与全球创新药研发服务,不断提升创新能力,完善医药外包服务链,拓展国际服务外包领域和产品。在基础研究、药物发现、临床前研究、临床研究的研发国际服务外包链条上,重点发展符合国际规范的新型药物安全评价、药理药效、药代、新型制剂、临床试验等领域,着力向大分子药物、医疗器械、植物药、食品、农药等更多领域拓展。‘十二五’末,初步形成较为完整的医药研发国际服务外包产业链,离岸业务力争达到30亿美元。”
受此政策影响。
(3)GLP实验室监管强化列入“十二五”发展规划
2012年1月,国务院印发《国家药品安全“十二五”规划》,这是我国第一个关于药品安全的独立规划。《国家药品安全“十二五”规划》指出,要建立健全药物非临床安全性评价实验室、药物临床试验机构监督检查体系和监管机制,探索建立分级分类监督管理制度;同时要求所有新药申请的非临床研究数据必须来源于符合《药物非临床研究质量管理规范》的机构。
随着国家对药品安全重视程度的不断加大,药品研制技术指导原则和数据管理标准将不断提高,与此同时,对于药物非临床安全性评价实验室的认证和监管力度也将会不断提升。具备GLP认证,并拥有较高技术操作规范和丰富行业经验的CRO企业未来将迎来更大的竞争优势和发展机遇。
(4)技术人才培养有利于行业的持续发展
国家重视对医药领域急需的科技创新、质量管理、国际化运作等方面人才的培养和引进,支持引导企业与高等院校、科研院所合作,联合培养高层次人才。具备较高专业素养和实践技能的行业技术人才为行业的发展提供了人才基础,有利于行业的持续发展。国内的高校扩招供应了大量化学制药、生物制药类专业的毕业生。此外,伴随着中国CRO行业的快速发展,大量的海外人才及中国留学生不断向国内流动,对我国医药研发外包能力提升发挥了关键性作用。
(5)跨国药企将研发工作转移到新兴市场,离岸外包业务规模扩大
由于专利药到期、新药研发速度变慢以及专利政策的调整,跨国制药企业面临着收入增长放缓的压力。为了提高新药投放效率,跨国制药企业开始在全球范围整合研发体系,将部分研发工作转移到新兴市场国家。由于中国具有庞大的医药市场、人数众多的化学与生物工程师以及服务能力日趋提高的本土CRO企业,我国在跨国制药企业中的战略地位越来越关键。虽然目前美国和印度占据了全球制药企业的离岸外包业务的主要份额,但中国因其相对较低成本、高技术能力的人力资源优势正在吸引全球制药企业将中国作为其核心研发和外包基地之一,这一趋势为我国CRO产业带来了积极的影响,将进一步促进了我国临床前CRO行业的加速发展。
2、临床前CRO行业发展不利因素:
(1)国际CRO机构进入给国内CRO机构带来挑战
随着全球医药产业链条向新兴市场转移,跨国大医药公司也纷纷将研发业务移至人才充足、成本较低、资源丰富的市场,中国CRO产业前景最被看好。与此同时,国外大型CRO如Quintiles、Covance、CharlesRiver等陆续进军大陆市场。这些国际CRO机构成立时间长,资金实力雄厚,研发技术水平高,业务覆盖领域广,因而将给本土CRO机构的发展带来挑战。
(2)制药企业研发能力薄弱制约行业的发展
目前国内共有近8,000家药品生产企业,但创新能力弱,高端研发能力不足:绝大部份中小制药公司几乎没有新药研发能力;少数较大规模制药公司已设立了专门的新药研发机构,但新药研发投入资金、新药研发的战略规划以及相应的管理和新药研发高层管理者的学术水平等与发达国家相比还有很大的差距。此外,CRO企业受限于资金和知识、技能积累的不足,其自身的研发能力总体也较薄弱,因而也制约了CRO行业的发展。