药品医疗设备行业监管体制及主要政策
1、药品医疗设备行业主管部门
药品和医疗器械,由于药品及医疗器械直接关系到人体健康与生命安全,因此是国家重点管理的行业之一。行业主管部门主要有国家发展和改革委员会、国家药监局等。行业自律组织包括中国医疗器械行业协会、中国医药协会和地方医药协会、中国医药保健品进出口商会等。
国家发改委主要负责研究拟订药品及医疗器械行业发展规划,组织实施产业政策,指导行业结构调整及行业管理。
国家及地方食品药品监督管理局主要负责药品和医疗器械的研究、生产、流通和使用进行行政监督和技术管理,制定药品、医疗器械等安全监督管理的政策,拟订国家药品、医疗器械标准并监督实施,组织开展药品不良反应和医疗器械不良事件监测等。
中国医疗器械行业协会是行业自律性组织,主要负责医疗器械产业及市场研究,代表会员企业向政府有关部门提出产业发展建议与意见,维护医疗器械企事业单位合法权益,对会员企业提供公共服务并进行行业自律管理等。
中国医药保健品进出口商会是商务部下属的六大进出口商会之一,其目的是建立由政府的行政管理、企业的业务经营、商会的协调服务三部分组成的外贸新体制。其业务协调范围涵盖中药、西药原料和制剂、医疗器械、保健器材、医用敷料、生物药、保健品、功能性化妆品等行业企业和产品。
2、药品医疗设备行业管理体制
(1)医疗器械行业管理制度
①国家对医疗器械实行分类管理
我国对医疗器械实行分类管理。第Ⅰ类是指通过常规管理足以保证其安全性、有效性的医疗器械。第Ⅱ类是指对其安全性、有效性应当加以控制的医疗器械。第Ⅲ类是指植入人体,用于支持、维持生命,对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。医疗器械分类目录由国家药监局依据医疗器械分类规则,协同国务院卫生行政部门制定、调整、公布。
②国家对医疗器械产品实行注册与备案制度
我国对医疗器械产品实行注册与备案制度。生产第Ⅰ类医疗器械,由设区的市级食品药品监督管理部门备案管理;生产第Ⅱ类医疗器械,由省、自治区、直辖市食品药品监督管理部门审查批准,并发给产品注册证书;生产第Ⅲ类医疗器械,由国家食品药品监督管理部门审查批准,并发给产品注册证书。
③国家对医疗器械生产企业实行分类管理
我国对医疗器械生产企业实行分类管理制度。开办第Ⅰ类医疗器械生产企业,应当向省、自治区、直辖市食品药品监督管理部门备案;开办第Ⅱ类、第Ⅲ类医疗器械生产企业,应当经省、自治区、直辖市食品药品监督管理部门审查批准,并取得《医疗器械生产许可证》。
(2)药品行业管理制度
①药品生产许可证制度
《中华人民共和国药品管理法》规定,开办药品生产企业,须经企业所在地省、自治区、直辖市人民政府药品监督管理部门批准并取得药品生产许可证,凭药品生产许可证到工商行政管理部门办理登记注册。无药品生产许可证的,不得生产药品。药品生产许可证应当标明有效期和生产范围,到期重新审查发证。
②药品生产质量管理规范(GMP)制度
药品生产企业必须按照国务院药品监督管理部门制定的《药品生产质量管理规范(GMP)》组织生产。药品监督管理部门按照规定对药品生产企业是否符合《药品生产质量管理规范》的要求进行认证;对认证合格的,发给认证证书。只有持有认证证书的企业才能进行认证范围内的药品生产。
③药品注册管理
根据新的《药品注册管理办法》,药品注册申请包括新药申请、仿制药申请、进口药品申请、补充申请和再注册申请。
新药申请是指未曾在中国境内上市销售的药品的注册申请。已上市药品改变剂型、改变给药途径、增加新适应症的,按照新药的程序申请。企业研究并申请新药须经药物临床前研究、临床研究后申请新药生产,国家药监局依法发给《药品注册批件》和新药证书。国家药监局根据保护公众健康的要求,可以对批准生产的新药品种设立监测期。监测期内的新药,国家药监局不批准其他企业生产、改变剂型和进口。
再注册申请是指药品批准证明文件有效期满后申请人拟继续生产或者进口该药品的注册申请。国家药监局核发的药品批准文号、《进口药品注册证》或者《医药产品注册证》的有效期为5年。有效期届满,需要继续生产或者进口的,申请人应及时向所在地省、自治区、直辖市食品药品监督管理部门申请再注册。
凡已正式受理的再注册申请,其药品批准文号在再注册审查期间可以继续使用。
④国家药品标准制度
国家药品标准是指国家为保证药品质量所制定的质量指标、检验方法以及生
产工艺等技术要求,包括国家药监局颁布的《药典》、药品注册标准和其他药品
标准。国家药监局组织国家药典委员会,负责国家药品标准的制定和修订。
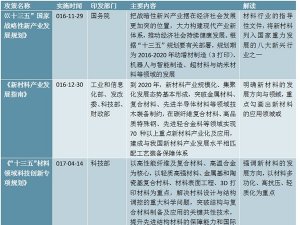
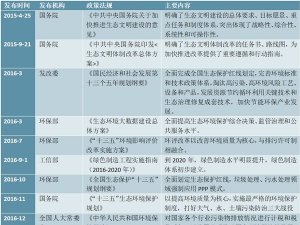
3、药品医疗设备行业主要法律法规和政策
(1)行业主要法律法规
医药行业的法律法规分为国务院制定的法规、国家药监局制定的规章以及国家药监局制定的规范性文件三个层次。我国颁布的有关医药行业的主要法律法规如下:
2014-06-01、《医疗器械监督管理条例》、国务院
2000-04-10、《医疗器械分类规则》、国家食品药品监督管理局
2000-07-01、《医疗器械生产企业质量体系考核办法》、国家食品药品监督管理局
2002-05-01、《医疗器械标准管理办法》、国家食品药品监督管理局
2004-04-01、《医疗器械临床试验规定》、国家食品药品监督管理局
2004-08-09、《医疗器械经营企业许可证管理办法》、国家食品药品监督管理局
2006-01-19、《医疗器械生产日常监督管理规定》、国家食品药品监督管理局
2011-01-01、《医疗器械生产质量管理规范(试行)》、国家食品药品监督管理局
2011-01-01、《医疗器械生产质量管理规范检查管理办法(试行)》国家食品药品监督管理局
2011-07-01、《医疗器械召回管理办法(试行)》、卫生部
2014-10-01、《医疗器械注册管理办法》、国家食品药品监督管理局
2014-10-01、《医疗器械生产监督管理办法》、国家食品药品监督管理局
2014-10-01、《医疗器械经营监督管理办法》、国家食品药品监督管理局
2014-10-01、《医疗器械说明书和标签管理规定》、国家食品药品监督管理局
2001-12-01、《中华人民共和国药品管理法》、全国人大常委会
2002-09-15、《中华人民共和国药品管理法实施条例》、国务院
2011-03-01、《药品生产质量管理规范》、卫生部
2013-06-01、《药品经营质量管理规范》、卫生部
2011-08-02、《药品生产质量管理规范认证管理
办法》、国家食品药品监督管理局
2003-04-24、《药品经营质量管理规范认证管理
办法》、国家食品药品监督管理局
2007-10-01、《药品注册管理办法》、国家食品药品监督管理局
2016-03-24、《医疗器械临床试验质量管理规范》、国家食品药品监督管理总
局、国家卫生和计划生育委员会
2017-01-19、《医疗器械质量管理体系用于法规的要求》、国家食品药品监督管理总局