疫苗行业监管体制及主要政策
1、疫苗行业主管部门及监管体制:
主要监管内容如下:
(1)国家卫生和计划生育委员会
国家卫生和计划生育委员会负责统筹规划医疗卫生和计划生育服务资源配置,组织制定国家药物政策和国家基本药物制度,监督管理公共卫生和医疗服务等。国家卫计委制定免疫策略和规划,对疫苗行业有直接的影响。
(2)国家食品药品监督管理总局
国家食品药品监督管理总局是我国医药行业的主管部门,负责起草药品和医疗器械的法律法规草案,拟订政策规划,制定部门规章,组织制定、公布国家药典等药品和医疗器械标准、分类管理制度并监督实施等。
(3)中国食品药品检定研究院
中国食品药品检定研究院为国家食药监总局直属单位,是国家检验药品、生物制品质量的法定机构和最高技术仲裁机构,依法承担实施药品、生物制品、医疗器械、食品、保健食品、化妆品、实验动物、包装材料等多领域产品的审批注册检验、进口检验、监督检验、安全评价及生物制品批签发,负责国家药品、医疗器械标准物质和生产检定用菌毒种的研究、分发和管理,开展相关技术研究工作。
(4)中国疾病预防控制中心
中国疾病预防控制中心是由政府设立的实施国家级疾病预防控制与公共卫生技术管理和服务的公益性事业单位。其主要职责是在国家卫计委领导下,围绕国家疾病预防控制重点任务,加强对疾病预防控制策略与措施的研究,做好各类疾病预防控制工作规划的组织实施;开展食品安全、职业安全、健康相关产品安全、放射卫生、环境卫生、妇女儿童保健等各项公共卫生业务管理工作,大力开展应用性科学研究,加强对全国疾病预防控制和公共卫生服务的技术指导、培训和质量控制,在防病、应急、公共卫生信息能力的建设等方面发挥重要作用。
2、疫苗行业主要法律法规及政策:
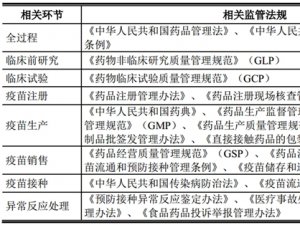
(1)行业基本法律法规
2015年4月24日、药品的研制、生产直到临床使用的全过程、中华人民共和国药品管理法(2015年修订)、我国药品管理的基本法,对在我国境内进行的药品研制、生产、使用和监督等活动都做出规定
2002年9月15日、、中华人民共和国药品管理法实施条例、根据药品管理法,进一步明确对药品生产和经营企业、药品的管理、监督
2003年9月1日、为申请药品注册而进行的非临床研究、药物非临床研究质量管理规范(GLP)、对药品临床前研究的组织结构以及实验设备、材料、操作及记录做出详细规定
2003年9月1日、药品临床研究、药物临床试验质量管理规范(GCP)、对药物临床试验全过程的标准进行规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告等
2011年3月1日、药品生产、药品生产质量管理规范(GMP)、对药品生产全过程的所有环节做出规定,确保药品质量
2007年10月1日、药品注册、药品注册管理办法、规定了药品注册的标准及具体组织实施注册的管理办法
2004年8月5日、药品生产、药品生产监督管理办法、规范药品生产企业的申办审批、许可证管理、委托生产以及监督检查
2006年3月8日、疫苗流通、使用、疫苗储存和运输管理规范、加强疫苗储存、运输管理,保证疫苗质量,保障预防接种的安全性和有效性
2004年7月13日、生物制品的检验放行、生物制品批签发管理办法、每批制品出厂上市或者进口时进行强制性检验、审核的制度。检验不合格或者审核不被批准者,不得上市或者进口
2015年12月1日、生物制品生产检验、中华人民共和国药典(2015年版)、规定了生物制品质量标准和检验方法
2011年7月1日、药品使用、药品不良反应报告和监测管理办法、药品不良反应报告、监测督管理以及监
2007年12月10日、药品召回、药品召回管理办法、规定了药品召回的原因、程序和相关的报告、监督管理办法
2016年3月1日、药品研制、生产、经营、使用、食品药品投诉举报管理办法、规定了投诉举报承办部门的职责、受理、办理程序以及投诉举报信息的管理
2016年4月25日、疫苗流通和接种、疫苗流通和预防接种管理条例、规范疫苗的销售和采购行为,规范疫苗的流通、配送、冷链运输、追溯和使用管理,强化疫苗流通和使用的监督检查
2016年7月20日、药品经营、药品经营质量管理规范(GSP)、加强药品经营质量管理,规范药品经营行为,保障人体用药安全、有效
资料来源:公开资料整理
(2)支持行业发展的主要政策:
《国家中长期科学和技术发展规划纲要(2006~2020年)》、国务院、2015年4月24日、《规划纲要》是新时期指导我国科学和技术发展的纲领性文件。《规划纲要》指出:生物技术和生命科学将成为21世纪引发新科技革命的重要推动力量,基因组学和蛋白质组学研究正在引领生物技术向系统化研究方向发展。依据《规划纲要》,生物行业是规划发展领域,未来将持续得到支持和发展
《促进生物产业加快发展的若干政策》、国务院、2002年9月15日、加快把生物产业培育成为高技术领域的支柱产业和国家的战略性新兴产业,重点发展预防和诊断严重威胁我国人民群众生命健康的重大传染病的新型疫苗和诊断试剂
《关于加快培育和发展战略性新兴产业的决定》、国务院、2003年9月1日、大力发展用于重大疾病防治的生物技术药物、新型疫苗和诊断试剂、化学药物、现代中药等创新药物大品种,提升生物医药产业水平
《国民经济和社会发展第十二个五年规划纲要》、全国人民代表大会、2003年9月1日、培育发展战略性新兴产业,以重大技术突破和重大发展需求为基础,促进新兴科技与新兴产业深度融合,在继续做强做大高技术产业基础上,把战略性新兴产业培育发展成为先导性、支柱性产业。生物产业重点发展生物医药、生物医学工程产品、生物农业、生物制造
《产业结构调整指导目录(2011年本)(2013年修正》、国家发展和改革委员会、2011年3月1日、将“现代生物技术药物、重大传染病防治疫苗和药物、新型诊断试剂的开发和生产,大规模细胞培养和纯化技术、大规模药用多肽和核酸合成、发酵、纯化技术开发和应用,采用现代生物技术改造传统生产工艺”列为鼓励类产业
《“十二五”生物技术发展规划》、中华人民共和国科学技术部、2007年10月1日、围绕艾滋病、病毒性肝炎、结核病等重大传染病,突破临床诊断、预测预警、疫苗研发和临床救治等关键技术,研制新型诊断试剂和新型疫苗,有效降低艾滋病、病毒性肝炎、结核病的新发感染率和病死率。建立疫苗和抗体的大规模和快速反应生产新技术,系统的疫苗效果及质量评价技术体系,人源化抗体构建及优化技术;对传统疫苗进行改造增效,针对新发、再发重大传染病和多发感染性疾病研制新疫苗和抗体药物;针对恶性肿瘤、心脑血管疾病、代谢性疾病、自身免疫性疾病等重大非感染性疾病,研制治疗性疫苗和抗体药物
《疫苗供应体系建设规划》、国务院、2004年8月5日、到2015年,初步建成满足我国经济社会发展需要的疫苗供应体系,通过对薄弱环节的重点建设,实现常态必保,应急能力大幅提升。到2020年,我国疫苗供应体系进一步健全完善,具备与发达国家同步应对突发和重大疫情的实力
《卫生事业发展“十二五”规划》、国务院、2006年3月8日、完善医药产业政策,鼓励医药企业兼并重组,提高产业集中度,支持企业加快技术改造,增强产业核心竞争力和可持续发展能力。提高免疫规划疫苗常规接种率和流动人口预防接种管理质量。恢复并维持无脊髓灰质炎状态,努力实现消除麻疹的目标。加强重点人群乙肝疫苗接种工作
《生物产业发展规划》、国务院、2004年7月13日、大力推进生物技术研发和创新成果产业化,一批生物科技重大基础设施相继建成,治疗性疫苗与抗体、细胞治疗、转基因作物育种、生物能源作物培育等一批关键技术取得突破,人用高致病性流感疫苗、分子诊断试剂、超级水稻、聚乳酸等一批创新产品得到推广应用。大力开展生物技术药物创制和产业化,促进疫苗升级换代,重点推动新型疫苗(包括治疗性疫苗)研发和产业化
《关于深化药品审评审批改革进一步鼓励创新的意见》、国家食品药品监督管理局、2015年12月1日、转变创新药审评理念、调整仿制药审评策略、加强药物临床试验质量管理、鼓励儿童药物的研制
《全国食品药品监管系统法治宣传教育第七个五年规划(2016-2020年)》、国家食品药品监督管理总局、2011年7月1日、做好新时期食品药品监管法治宣传教育工作