中国仿制药一致性评价主要政策汇总及仿制药一致性评价重大意义分析
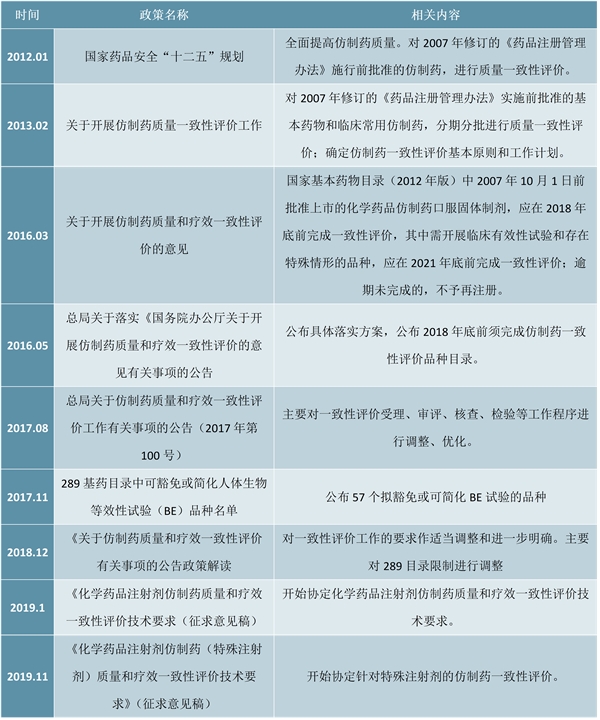
近年来,我国仿制药市场一直在改革。早在2012年,CFDA就启动15个试点品种的质量一致性评价工作,涉及20家药品生产企业。具体任务是2018年底要完成2007年10月1日前批准的《国家基本药物目录》中化学药品仿制药口服固体制剂的质量一致性评价。2016年5月,CFDA出台了具体要通过仿制药一致性评价的289目录,仿制药一致性评价开始大力推动。
随着2017年年底第一批口服制剂通过仿制药一致性评价,截至2019年11月14日,根据中国上市药品目录集数据,我国通过仿制药一致性评价的批文数达到287条。加上按化学药品新注册分类批准的仿制药(视同通过仿制药一致性评价),我国已有128个品种完成仿制药一致性评价,这不但提升我国整体仿制药质量,使得我国仿制药正式进入通用名时代,也为仿制药带量采购在药品遴选上奠定良好的基础,推动国产仿制药实现进口替代。
2012-2019年中国仿制药一致性评价主要政策汇总情况
首先,仿制药一致性评价可以降低患者的用药费用,通过一致性评价的仿制药,在质量上和原研药一致,由于仿制药投入研究的周期短,研究费用没有原研药那么高,所以价格往往比原研药低很多,如果临床用药上优先选用可以替代的仿制药,可以很大程度上降低患者的用药费用。
其次,通过一致性评价,我国仿制药在质量和疗效上都会有大幅度提高。最后,仿制药一致性评价将促进我国药企的优胜劣汰,目前很多药企为获得更多竞争力已经在加强新药研究。

