我国医药行业投资方向分析:肿瘤免疫领域和干眼病方向相关企业
一、肿瘤免疫领域投资策略:高技术壁垒条件下,已有产品上市或研发进度靠前的企业将脱颖而出
(1)免疫检查点抑制剂:研发管线进度靠前的企业值得关注。国内有十余家企业布局该领域,君实生物、信达生物、恒瑞医药已有PD-1药物获批上市,留给后进企业的机会相对较少。
(2)CAR-T细胞疗法:建议关注进度较为领先的企业。2019年5月底全球已获批或在研细胞疗法项目数量已达到1011个,目前国内南京传奇的BCMA药物和明聚生物的CD19药物已进入临床II期。
(3)溶瘤病毒:建议关注布局溶瘤病毒与肿瘤免疫检查点抑制剂的联用的企业。溶瘤病毒经过百年曲折发展,直至安进的T-vec上市,到上市后也因疗效不佳市场表现平平,直至溶瘤病毒与肿瘤免疫检查点抑制剂的联合疗法的出现,溶瘤病毒重新焕发了新的活力。溶瘤病毒与肿瘤免疫检查点抑制剂的联用大大提高了溶瘤病毒的疗效,是未来的发展方向之一。
(4)肿瘤疫苗:建议关注研发实力已初步得到认证的企业。目前癌症疫苗的研发从全球来看都处于比较早期的阶段。癌症疫苗的研发难度大,成功上市的Provenge疫苗研制的时间跨度达20年之久,还有很多项目在III期终止。所以肿瘤疫苗领域还待进一步观望,建议关注临床进度靠前的企业,如海欣药业,南京新百。
二、干眼病和AMD领域投资策略:专注竞争力产品研发的企业将脱颖而出
(1)干眼病:建议关注拥有竞争力产品的企业。在干眼病领域,国内已有多家企业在研发治疗作用更好的干眼病用药,因为疗效更好的药物将拥有更强的发展潜力。亿胜生物科技的在研产品有独特的进入线粒体内清除ROS,以靶向阻断眼部氧化应激反应的机制,预计将有较好的治疗效果。(2)AMD:建议关注布局更多适应症的企业。目前国内三款针对VEGF靶点的wAMD药物已占据先发优势,后来产品只有针对更高效的结合方式或更换靶点/靶点联用,才可能解决这类靶点的不足。对于已有上市产品的企业,加快布局更多适应症的获批,将加强其产品竞争力,获得更好的发展。如国内龙头康弘药业积极布局更多适应症,今年5月康柏西普获批治疗DME,且积极拓展国际市场,未来发展空间广阔。
1、君实生物(1877.HK):专注于单抗开发的国内领先企业
上海君实生物医药科技股份有限公司是一家以开发治疗性抗体为主的研发型高科技公司,2018年未有药物销售收入。2018年,公司并未商业化任何药物,因此没有任何药物收入,当年营业收入全部为咨询服务费和提供药物研究服务所得,仅为900万元,但由于2018年年末,公司的PD-1单抗获批上市,其于2019年进行商业化生产,预计公司收入将大规模提升。
公司技术平台先进,在研产品十余款,产品特瑞普利单抗成为我国首个获批上市的国产PD-1抗体药物。1)公司平台:公司自成立以来瞄准国际抗体技术研发的前沿进展,通过广泛的国内外技术合作,着力研发条件、研发团队和技术平台的建设,已搭建国内一流创新人源化抗体药物产品研究开发技术平台。该平台涵盖分子抗体药物筛选、高产稳定CHO细胞株的构建及治疗性抗体分析检测在内的多个核心技术。2)公司产品管线:目前在研管线十七种,包括十一个肿瘤免疫疗法药物,是国内首家就抗PCSK9单克隆抗体和抗BLyS单克隆抗体取得NMPA的IND申请的中国公司。2018年12月17日,特瑞普利单抗成为首个获批上市的国产PD-1抗体药物。
2、复星凯特:KitePharma和复星医药合资公司,已启动Yescarta国内IND临床试验
复星凯特生物科技有限公司为上海复星医药集团与美国KitePharma在中国上海设立的合作企业,立足于自主研发和技术转移相结合,致力于肿瘤免疫细胞治疗技术的开发和产业化。公司在2017年4月正式成立,12月,按照Kite的商业化生产厂房的设计理念,国家药品生产质量管理规范(GMP)标准设计的细胞治疗产业化基地落成并完成验证,2018年5月,公司向CDE递交了FKC876的新药临床试验(IND)申请,8月,IND申请(批件号2018L02991)获批,10月,公司FKC876的临床研究通过了中国人类遗传资源办公室的审批。
复星凯特获得Yescarta在中国的全面技术转让和商业许可,并已在中国启动临床试验。FKC876(美国商品名称Yescarta)是全球首款获批治疗NHL的CAR-T细胞治疗药物,公司已获得该产品在中国的全面技术转让和商业许可权。FKC876主要适应症是复发难治侵袭性非霍奇金淋巴瘤(NHL),I/II期临床试验结果显示,108例难治性大B细胞淋巴瘤患者中接受Yescarta治疗并有机会接受12个月随访后,总缓解率为82%,完全缓解率达到了58%。除Yescarta以外,复星凯特研发管线还包括多个CAR-T/TCR-T临床阶段品种和早期创新研发项目。
3、李氏大药厂(0950.HK):拥有国内进展最快的溶瘤病毒
李氏大药厂通过自主研发和海外引进,拥有58个储备产品管线,包括15个创新药,2018年归母净利润达到4.18亿元。公司成立于1998年,是一家由具有海外知名药企工作经验的海归博士创立的研发型药企,通过自主研发和海外优质成熟产品引进代理迅速成长,2002年在香港挂牌上市。目前公司通过立足自主研发、与全球超过30家药企合作将优质在研项目以licensein的方式形成了强大的储备产品管线,共58个储备产品,包括15个创新药、20个高端仿制药、13个改良创新药;其中26个为自主研发,32个国外引进或进口。2018年,公司经营业绩良好,营业收入达到11.38亿元,同比上涨12.78%,归母净利润达到4.18亿元,同比上涨79.4%
溶瘤病毒Pexa-Vec为近十余年国内首个进入临床Ⅲ期的溶瘤病毒。李氏大药厂于2009年获得Jennerex的Pexa-Vec在中国大陆、香港和澳门针对肝癌和其他癌种的独占许可,支付Jennerex头款、里程碑款和上市销售后的特许权使用费,同时参与全球性临床试验的实施,负担III期临床15%的费用。2017年7月CFDA批准Pexa-Vec一线治疗肝细胞癌的PHOCUS试验,比较Pexa-Vec和索拉非尼治疗和只接受索拉非尼治疗的对照组的总体生存期,目前已进入临床III期,预计2020年获批上市,有望抢先占领肝癌一线治疗患者这个庞大的市场。
4、科济生物:亚太地区领先的CAR-T细胞免疫治疗公司
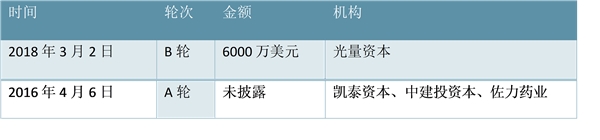
科济生物是中国及亚太地区领先的CAR-T细胞免疫治疗公司,目前公司已获得两轮融资。公司于2014年10月成立于上海,以提高病人生存期、改善生活质量为目标,致力于全球肿瘤免疫治疗的创新与发展,拥有多个CAR-T专利技术。在融资方面,目前公司已获得两轮融资,由凯泰资本、中建投资本、佐力药业等机构投资。
科济生物以获得两轮融资
资料来源:公开资料整理
公司在CAR-T细胞免疫治疗领域领先。目前公司已经开展了多个全球第一及全球领先的CAR-T临床试验:2015年5月科济生物开展全球领先的脑胶质瘤CAR-T临床试验;2015年6月科济生物开展全球首个针对肝细胞癌的CAR-T临床试验;2017年5月科济生物启动全球首个Claudin18.2临床研究用于治疗胃癌、胰腺癌。在产业化方面,公司上海CAR-T细胞制备中心已于2017年4月落成。在产品研发进度方面,公司11款CAR-T细胞治疗产品已有5个产品已经进入临床试验,治疗疾病覆盖肝细胞癌、肺鳞癌、胰腺癌、脑胶质瘤、B细胞白血病&淋巴瘤、胃腺癌、多发性骨髓瘤等,涵盖实体瘤和血液肿瘤。
5、康弘药业(002773.SZ):国内眼科用药的龙头企业
康弘药业成立逾20年,凭借康柏西普成为国内眼科用药领域企业的领跑者,2019年扣费归母净利润达到6.29亿元。康弘药业1996年成立,业务包括生物制品、中成药及化学药研发、生产、销售及售后服务,并拥有生物制品、中成药、化学原料药和化药制剂等多个生产基地,以及遍布全国的营销网络。2015年6月26日,康弘药业在深圳证券交易所挂牌上市。康柏西普研究团队从2007年开始组建,2013年11月获国家药监局批准wAMD的治疗,是我国一类生物创新药,并是我国首个自主研发的治疗wAMD的药物,其国际通用名“Conbercept”于2012年被世界卫生组织批准,成为中国第一个拥有完全自主知识产权的生物制品国际通用名。康柏西普主要为融合蛋白,针对VEGF家族多个靶点起抑制作用,并且注射次数上更少,对当时唯一上市产品雷珠单抗有疗效非劣效性、顺应性、和价格上的优势,产品也因此快速突围。公司经营业绩良好,2018年,营业收入达到29.17亿元,同比上涨4.7%;扣费归母净利润达到6.29亿元,同比上涨0.32%。
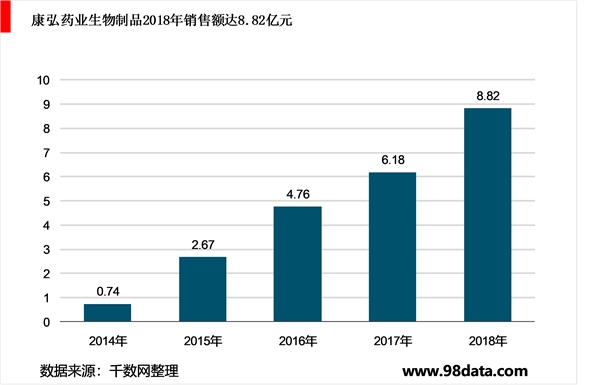
康柏西普销量快速增长,更多的适应症将获批,有望打开国际市场。康柏西普上市后在市场份额上增长迅速。根据IMS数据,2018年国内样本医院抗新生血管眼药市场为1.41亿元,抗VEGF眼药占据99%的市场份额,其中康柏西普用药占据46%。根据公司年报,2018年生物制品(主要为康柏西普注射液)收入约8.82亿元人民币,同比增长42.79%。康柏西普刚上市时的适应症为wAMD、pmCNV。2019年5月17日,康柏西普获国家药监局批准用于DME的治疗,成为此领域继阿柏西普之后的第二款药物。另外,CRVO、BRVO的临床试验已经到了临床三期,CRNV(角膜新生血管)的I期临床试验已获批准。为了打开国际市场,康柏西普在美国进行主题为“与阿柏西普头对头试验验证其非劣效性”的临床试验,目前进行至临床三期。如果临床试验顺利,康柏西普未来有望登陆国外市场,企业也因此获得更大利润。