中国医药包装材料行业发展及主要进入壁垒
(一)、医药包装材料行业发展
建国初期,国内制药企业以制剂为主,生产方式落后,药品包装简单、原始;20世纪50年代中后期至70年代末,我国医药包装行业取得了一定发展,出现了一批药用玻璃厂、橡胶塞厂(车间)等医药包装厂家,但在总体上仍处于现代化生产的初始阶段,期间的各类产品在质量、技术水平等方面与国际水平差距较大。
为逐步改变落后的状况,自20世纪80年代起,国家相关管理部门开始重点推广新技术、新工艺、新材料,我国药包材行业进入了快速发展的新阶段,各类现代化药包材开始出现;与此同时,民众也逐渐认识到医药包装材料对于保障药品质量和用药安全的重要性,市场对药包材的重视度日益增强。自20世纪90年代末起,为统一药包材的产品技术标准、提高药包材质量,国家开始制定了多项国家标准和行业标准。2000年4月及2004年7月,国家食药监局分别颁布了《药品包装用材料、容器管理办法(暂行)》及《直接接触药品的包装材料和容器管理办法》,药包材注册审批制度正式实施。
药包材注册审批制度的实施使我国医药包装行业的发展步入快车道,一批具备资质的专业化药包材生产企业逐渐成为了市场的主导力量,药包材也从早期的玻璃、橡胶塞发展成为种类丰富、性能全面的各类药包材。自药包材注册审批制度颁布实施10多年来,我国医药包装行业已逐步发展成为一个产品门类比较齐全、创新能力不断增强、市场需求十分旺盛的朝阳产业。
(二)、医药包装材料行业的主要壁垒
(1)准入壁垒
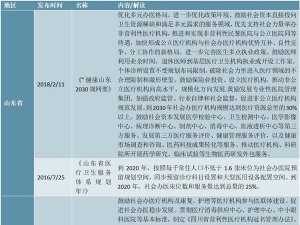
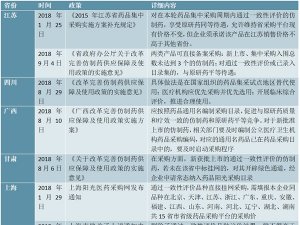
2016年8月以前,我国对药包材实施产品注册审批管理制度,药包材企业生产直接接触药品的包装材料和容器必须取得国家食药监局颁发的《药品包装用材料和容器注册证》。
2016年8月10日,国家食药监局发布《总局关于药包材药用辅料与药品关联审评审批有关事项的公告》(2016年第134号),根据该文,已批准的药包材、药用辅料,其批准证明文件在效期内继续有效,有效期届满后,可继续在原药品中使用。如用于其他药品的药物临床试验或生产申请,应按照本公告要求报送相关资料。批准证明文件在2017年12月31日(含当日)前到期的药包材、药用辅料,有效期延续至2017年12月31日。自2018年1月1日起,用于其他药品的药物临床试验或生产申请时,应按本公告要求报送相关资料。
无论之前的审批模式还是之后关联审批模式,均需国家食药监局进行审批,对药包材生产企业形成行业的准入壁垒。
(2)技术壁垒
医药包装行业属于技术密集型产业,药包材的生产不仅需要专用的设备,还要以专业技术为支撑。近年来,随着新药物、新剂型的不断涌现以及人们对药品包装安全的关注度不断提升,市场对药品包装也提出了更高的技术要求。按照工信部发布的《医药工业发展规划指南》,在医药包装领域,将加强药用辅料和直接接触药品的包装材料和容器的标准体系建设,增加国家标准收载品种,鼓励企业提高规范生产能力,提升质量控制水平。推动企业建立完善测量管理体系,促进提质增效。
医药包装行业产品研发及制造工艺的提高需要长时间的投入和准备,新进入的企业缺乏生产经验和专业技术,难以在短时间内生产出符合药包材质量要求并具有较强市场竞争力的产品。随着医药工业的发展,药包材设计和制作的复杂性不断增加,技术含量持续提升,这对行业新进者形成了较高的技术壁垒。
(3)资金壁垒
医药包装是一个高资金投入的行业,特别在对药包材质量要求更加严格的趋势下,需要行业新进者有较强的资金实力作保障:第一,机器设备等固定资产投入较大,关键性机器设备的购置成本较高,如果生产高性能产品,可能还需要从国外进口;第二,为满足不同药物的需要,医药包装材料始终处在持续的发展和创新中,产品的研发创
新和质量检验需要花费较多的费用。
(4)渠道壁垒
医药包装企业的主要客户通常为制药企业,其与医药包装企业形成合作关系后,一般具有较强的粘性,主要原因为:为满足药品的安全性要求,制药企业选择医药包装企业时,通常需对药包材生产企业定期进行现场质量审计和回顾分析,考察药包材与药品的相容性,其耗时一般不低于半年;如药包材的原料、处方、生产工艺等发生变更,制药企业应重新进行相容性验证。制药企业出于药品安全性及相容性验证时间成本等因素的考虑,一般不会轻易更换现有的合格供应商,从而形成了行业的渠道壁垒。